神经胶质瘤、脑胶质瘤最新研究进展一览。2017年8月30日 讯 /生物谷BIOON/ --本期为大家带来的是神经胶质瘤的病理学研究以及相关的治疗方法研究进展,希望读者朋友们能够喜欢。 1. 新型抗癌药物能够有效抑制神经胶质瘤的生长
 神经胶质瘤是一类主流的大脑肿瘤,即使接受了手术、放疗以及化疗,患者的存活时间依然很短。胶质瘤中一类叫做"胶质瘤干细胞"的亚群对于肿瘤的增生,对治疗的耐受性以及肿瘤的复发具有重要的作用。
最近,来自UAB的Ichiro Nakano博士等人与来自西安交大的Maode Wang博士等人合作发现了胶质瘤干细胞得以维持的新型分子机制。进一步,作者发现利用新型的针对性分子抑制剂能够对于神经胶质瘤的治疗具有潜在的效果。
首先,作者发现一类叫做OTS167的药物对于恶性的癌症的临床试验效果不理想,因此他们计划研究神经胶质瘤对该药物产生耐受性的内在机制。作者发现神经胶质瘤在受到OTS167治疗之后会出现一类新型分子靶点-NEK2。通过利用CMP3a靶向NEK2,神经胶质瘤的生长能够得到显著的抑制,并且该疗法结合放疗能够起到更佳的杀伤肿瘤的效果。
NEK2是一类此前研究较少的激酶蛋白,研究者们发现NEK2在胶质瘤干细胞中的表达量差异较大,而且NEK2对于神经胶质瘤的体外生长十分重要。小鼠肿瘤模型结果也表明该蛋白对肿瘤细胞产生放疗耐受性十分关键。
通过一系列的试验,研究者们发现NEK2促进肿瘤细胞生长以及耐受性产生的机制:他们发现NEK2蛋白能够与一类叫做EZH2的癌基因组蛋白甲基转移酶结合,从而保护EZH2不被降解,进而调节肿瘤干细胞的自我更新以及存活。
此前研究已经发现EH2在多种人类癌症中有较高的表达,同时EZH2表达量的升高会伴随着肿瘤恶化以及治疗效果的下降。
再一想临床试验中,作者发现NEK2的表达量与EZH2存在紧密的关联,而且也与患者的健康水平存在相关性。HEK2在复发的癌细胞中表达量会发生上调。因此,作者认为NEK2是一类重要的维持神经胶质瘤干细胞稳定性的因子,而特异性的抑制剂CMP3a则可以成为潜在的治疗药物。
2. Sci Trans Med:CAR-T疗法治疗神经胶质瘤为什么效果不佳?
Doi.scitranslmed.aaa0984
 最近一项临床试验表明遗传修饰的T细胞具有治疗神经胶质瘤的效果,然而,要想最终攻克这一癌症,还需要解决肿瘤微环境中的免疫抑制效应以及基因突变的复杂性。相关结果发表在最近一期的《Science Translational Medicine》杂志上。
过去两年来,来自宾夕法尼亚大学医学院的研究者们报道了利用CAR-T疗法治疗神经胶质瘤的临床试验结果,他们利用靶向肿瘤特异性抗原的EGFRvIII的CART技术对患者进行治疗。在最新的这一研究中,作者发现了该技术的两大瓶颈:其一是患者肿瘤组织中EGFRvIII的表达差异性较大;其二是肿瘤微环境具有较强的免疫抑制效应,这一效应在治疗过程中会逐渐严重。因此,作者认为需要同时寻找新的肿瘤抗原以及寻找克服免疫抑制效应的药物,从而实现对肿瘤组织的杀伤。
"这是一项初步阶段的临床试验,但我们希望细胞能够顺利到达肿瘤组织进行增殖,并且降低对患者的毒性。如果能够实现,那么将会成为供患者选择的治疗方案之一"。该文章的作者O'Rourke博士说道。
美国境内每年有22000人被诊断患有神经胶质瘤,该肿瘤具有较强的耐药性,而且患有该类癌症的患者寿命通常不会超过15个月。
该研究将患者分为三组,其中一组在接受CART细胞注射治疗后没有再次进行手术,第二组在治疗后较晚的时间接受了手术,第三组在治疗后较早的时间内做了手术。在细胞注射治疗之后的两个星期内,能够检测到CART- EGFRvIII细胞向肿瘤组织中浸润,一个月内能够在血液组织中检测到上述细胞,而细胞的数量则在注射后两周左右发生平稳的下降,并且在一个月过后低于检测水平。
此外,作者发现CART细胞的免疫激活会受到反向的调节,其中包括免疫抑制类的信号通路活性的上调。"在细胞注射治疗之后肿瘤组织中会出现抑制性T细胞的大量增殖与活化,这意味着我们需要调节肿瘤微环境使之对CART更为友好"。
3. 神经胶质瘤与血糖之间存在关联?
 高血糖或糖尿病与罹患大多数癌症的风险增加有关。然而,有研究发现,脑部肿瘤,如神经胶质瘤在糖尿病和高血糖人群中并不常见。现在,一项最新研究开始揭示两者之间存在的这种惊人的联系。研究人员不禁问道,大脑肿瘤会对血糖水平造成很大影响吗?
这个研究小组的成员包括来自哥伦布俄亥俄州立大学(OSU)的研究人员,他们将最新研究成果发表在《科学报告》杂志上。
共同第一作者,俄亥俄州立大学流行病学副教授Judith Schwartzbaum说道,"糖尿病和血糖水平升高会使得身体几个部位罹患癌症的风险增加,包括结肠癌、乳腺癌和膀胱癌等。"
然而,对于神经胶质瘤等脑部肿瘤来说,情况完全不一样了。相反她补充道,"这些罕见的恶性脑部肿瘤更常见于血糖水平正常的人群,而不是那些高血糖或糖尿病人群。"
神经胶质瘤是最常见的大脑肿瘤之一。占所有原发性脑部肿瘤的四分之一,占所有恶性肿瘤的四分之三。
胶质瘤起源于大脑神经胶质细胞。神经胶质细胞不象神经元那样,传递与神经功能相关的电信号,相反,它们起到保护、维持和支持神经元的作用。
神经胶质瘤通常多发于中年人群。被确诊为胶质母细胞瘤(最常见的成人型神经胶质瘤)的患者平均生存期只有14个月。
研究小组对神经胶质瘤包括确诊前一段时间的血糖水平和糖尿病数据,以及它们与神经胶质瘤后续诊断的相关性进行了分析。
结果表明,高血糖人群及糖尿病患者不易发生神经胶质瘤。此外,两者之间存在的这种关联性在获得确诊前一年是最强的。
Schwartzbaum教授说,这一结果使他们的研究团队百思不得其解,"为什么血糖水平与脑肿瘤的关系与其他几种恶性肿瘤相反?"
他们在文章中也对一些可能的因素进行了讨论,或多或少能帮助我们理解一些。
例如,肿瘤本身会影响血糖水平吗?例如,众所周知,胰岛素样生长因子与神经胶质瘤复发有关,而糖尿病患者出现复发的几率要比非糖尿病患者少一些。
另一种解释可能源于大脑对葡萄糖的使用。虽然大脑仅占体重的2%,但人类大脑却要消耗大约20%的可用葡萄糖,"Schwartzbaum教授说道。
这些问题都有待进一步研究,看看血糖水平与脑部肿瘤之间存在的关联是否可用来开发治疗脑部肿瘤的新方法。
4. Int J Radiat Oncol:恶性胶质瘤治疗获得鼓舞人心的新进展
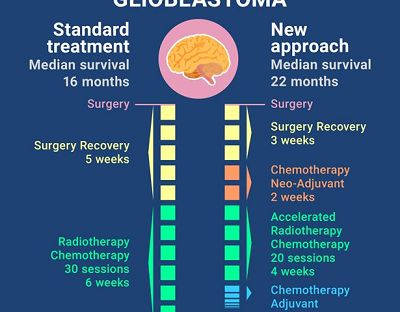 确诊患有恶性脑瘤对于病人及其亲友而言是一个毁灭性的打击,因为尽管部分癌症对治疗反应良好,但是像胶质瘤这类最常见、最恶性的脑瘤会在确诊后很短时间里复发并进展。诊断出胶质瘤的病人采用目前的标准疗法治疗的中位生存期仅为16个月。
基于最近关于化疗机理的研究,来自麦吉尔大学健康中心(MUHC)的研究小组开发了一种增强胶质瘤治疗疗效的新方法,成功将中位生存期延长至22个月,这为患胶质瘤的病人带来了希望。这项临床2期试验结果最近发表在International Journal of Radiology Oncology上。
"胶质瘤非常难治。"研究领导作者、MUHC放射肿瘤科医师George Shenouda说道,"这种肿瘤生长迅猛,会很快传遍大脑,使得通过手术完全切除肿瘤组织非常困难。"
胶质瘤的标准疗法包含通过手术切除尽可能多的肿瘤组织,并采用放疗联合化疗清除余下的肿瘤组织。病人在术后需要休息4-5周才能进行放疗。不幸的是在这段时间里,残余的癌细胞会继续生长。更不幸的是,残留的癌细胞,尤其是肿瘤干细胞更耐受放疗和化疗。
在他们的新方案中,研究人员在放疗之前给与病人化疗治疗,也叫做新辅助化疗。新辅助化疗可以防止肿瘤在病人康复期间进展,可以延长病人的生存期。
新辅助化疗之后,病人会接受加速放疗。"通过在更短的时间、更小的频率给与相同的放射剂量,我们能够更好地控制肿瘤。因此我们增加了治疗疗效,我们相信治疗还会靶向肿瘤干细胞,这些干细胞是癌症复发的基础。将放疗频率降低1/3也降低了病人的负担。此外,这意味着治疗费用降低不少。"Shenouda博士说道。
尽管还需要进一步研究,但是这些初步结果很令人鼓舞。"参与我们研究的50%的病人生存时间已经有2年,这是非常鼓舞人心的,我们对这些结果感到很高兴。"Shenouda博士说道。
5. Cell:基因WNT5A调节胶质瘤干细胞分化为内皮细胞样细胞
doi:10.1016/j.cell.2016.10.039
 多形性胶质母细胞瘤(glioblastoma multiforme)仍然是最为常见的高度致命性的脑癌,而且因它的复发能力而闻名于世。在一项新的研究中,来自美国德州大学MD安德森癌症中心的研究人员鉴定出一种允许癌细胞在大脑中侵袭性地扩散和生长的过程。相关研究结果发表在2016年11月17日那期Cell期刊上,论文标题为"Epigenetic Activation of WNT5A Drives Glioblastoma Stem Cell Differentiation and Invasive Growth"。
论文共同第一作者Baoli Hu博士说,"尽管接受外科手术移除、放疗和化疗等强化治疗,胶质母细胞瘤较差的预后与肿瘤几乎普遍存在的复发相关联。我们的研究表明基于靶向允许胶质母细胞瘤在大脑中侵袭性地重新生长的机制,人们有潜力开发出一种新的治疗策略。"
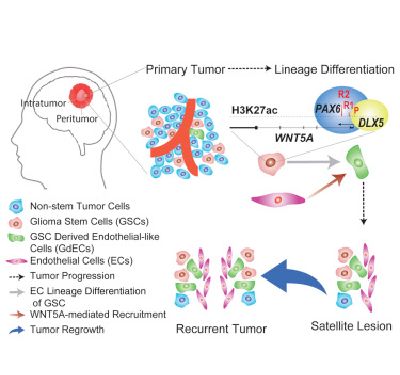
Hu和他的同事们开发出一种胶质母细胞瘤模型来确定胶质瘤干细胞的位置,其中胶质瘤干细胞像所有的干细胞那样能够变成其他的癌细胞。他们进一步发现基因WNT5A当被激活时允许胶质瘤干细胞发生转变,从而导致浸润性肿瘤生长。
Hu说,"我们发现受到基因WNT5A调节的胶质瘤干细胞变成内皮细胞样细胞(endothelial-like cell)。这些新的被称作GdEC的细胞招募现存的内皮细胞,从而形成一种支持远离原发性肿瘤的浸润性胶质瘤细胞生长的微环境,这经常会导致卫星病灶和疾病复发。"
临床证据揭示出相对于原发性肿瘤,WNT5A在这些卫星病灶和复发的肿瘤中具有更高的表达水平,而且GdEC也具有更高的数量,这就证实WNT5A介导的胶质瘤干细胞分化和胶质瘤细胞在整个大脑中扩散存在关联,从而导致这种癌症非常致命。
这项研究确定WNT5A在胶质瘤干细胞转化为GdEC中发挥着一种关键性的作用。这为开发一种新的治疗胶质母细胞瘤病人的策略提供可能。
近期的临床试验数据表明作为复发性胶质母细胞瘤的一线治疗药物,得到美国FDA批准的药物贝伐单抗(bevacizumab)并不能够通过靶向血管内皮生长因子(VEGF)来让病人获得益处。
Hu说,"我们的初步数据表明贝伐单抗可能增加WNT5A介导的GdEC分化和现存的内皮细胞的招募,而这种招募会给胶质母细胞瘤病人带来未被证实的益处。这种新的策略通过抑制新的肿瘤生长和浸润以及肿瘤复发而应当会改善接受抗VEGF疗法的脑癌患者的治疗结果。"
6. 重磅:鸡尾酒免疫疗法或可搞定胶质瘤!
 CLA的研究人员发现将UCLA开发的一种疫苗与其他实验性疗法及FDA批准的疗法联合在一起可以减小晚期脑胶质瘤的大小。这种特异性靶向脑胶质瘤的免疫疗法叫做自体肿瘤裂解液激活的树突状细胞疫苗(DCV)。这种疗法使用了病人的一部分脑部肿瘤组织,目前正在人体身上进行试验。
在动物实验中,研究人员发现将DCV与两种调节免疫系统不同方面的药物联合在一起使用可以让T细胞更有效进攻脑胶质瘤细胞。这两种额外的药物分别是一个PD-1抗体(促进肿瘤内的T细胞激活)和一个叫做PLX3397的实验性药物(可以减弱肿瘤内的免疫抑制效应)。
脑胶质瘤是成年人中最常见的一种恶性脑部肿瘤之一,也是致死率最高的一种恶性肿瘤。据估计今年将有12000人被诊断出患有胶质瘤,而令人痛心的是这些病人的五年生存率低于5%。同时,这种癌症复发的可能性很高,但是目前还没有针对复发肿瘤的标准疗法。研究人员在小鼠及肿瘤病人的肿瘤组织中进行了研究。
这项研究也许为研究人员指明了开发治疗胶质瘤及其他免疫抑制肿瘤联合疗法的新方向。 (责任编辑:yong) |

